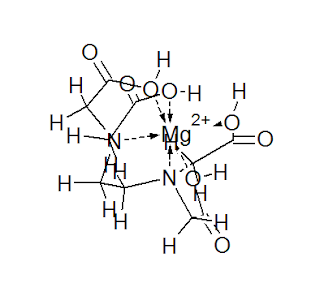
Um dos reagentes mais utilizados na química analítica de complexação é o EDTA ( Ethylene dia- mine tetraacetic acid), pois o mesmo apresenta-se muito estável na presença de diversos íons metálicos , principalmente o Magnésio(Mg) e o Cálcio(Ca).
Seu uso como complexante se deve ao fato de que a sua presença juntamente com íons já abordados, forma um quelato(complexo), uma vez que o reagente atua como agente quelante hexa dentado,(possui seis posições de coordenação,através de ligações covalentes), sendo assim, uma molécula de EDTA pode "agarrar" um outro íons, prendendo-o para si, formando uma estrutura heterocíclica, aumentado a massa do produto, e em muitos casos diminuindo também a sua solubilidade no meio, e em muitas vezes, variando a sua concentração, existe a precipitação desse produto.
O pH ideal para desprotonar completamente o EDTA é de 14.
O EDTA, no ramo da medicina é utilizado para o tratamento de intoxicações por metais pesados como o Chumbo(Pb) e o Mercúrio(Hg), formando um complexo solúvel que por sua vez é absorvido e eliminado pelos rins. Também
já foi relatado como a nova e "revolucionária" terapêutica para a
aterosclerose e de diversas outras enfermidades vasculares, modalidade
terapêutica - chamada quelação, contudo não surgiram provas da eficácia ou não
desse método.
Apesar dessas aplicações serem muito importantes, o EDTA, em suma, é utilizado para complexar o íon Cálcio(Ca), tornando assim, possível a determinação de varias propriedades do meio, como a dureza da água.
Águas duras são aquelas que exigem quantidades consideráveis de sabão para produzir espuma, em classificação empírica civil. Contudo, para definições científicas, a dureza é medida através da concentração de íons presentes nessas águas, em geral sua unidade de medida é em mg de CaCO(3) por litro de amostra.
No Brasil, essa taxa não pode ultrapassar os 500 mg, já em outros países, a classificação difere nas concentrações máximas, por exemplo, nos Estados Unidos, esse valor não deve ultrapassar os 17,2 mg, e um dos menores valores é o da França, com 10,0 mg. Deve-se ressaltar que um valor alto, implica em danos materiais elevados para industrias e residências, uma vez que tais íons com o passar do tempo vão se depositado nas tubulações e formando crostas, podendo chegar a entupir encanamentos ou diminuir sua vazão. Uma das soluções para casos que não podem serem modificados está na "lavagem" dessas tubulações com alguns ácidos fracos como o Ácido Acético.
O método clássico usado para essa determinação é a complexometria, onde coloca-se na bureta uma solução de EDTA com concentração muito bem conhecida (padronizada com padrão primário), e no erlenmeyer a amostra de água juntamente com um indicador o Negro de Eriocromo T(pesquise mais sobre), onde a coloração final é azul, indicando o ponto de "viragem".
Texto escrito por João Antônio G.K
Referências: Wikipédia, Portal de Periódicos da Capes, "Complexation Titrations." – Chemwiki,portal médico.
Imagens: criadas pelo escritor a partir do software ACD chemsketch(FREE)
Contado, dúvidas, sugestões: joao81901@hotmail.com

Nenhum comentário:
Postar um comentário